Abonnez-vous à notre infolettre!
Suivez les actualités de CATALIS - Recherche clinique Québec
En partenariat avec

Différentes réglementations provinciales, nationales et internationales régulent, tour à tour, l’autorisation, le déroulement, la fin et l'interruption d'un essai clinique. Si les résultats des essais cliniques sont satisfaisants, des autorisations fédérales et provinciales sont également requises pour rendre le nouveau traitement accessible à la population.
Toute demande d'essai clinique au Canada doit, avant tout, être approuvée par Santé Canada. Un dossier règlementaire contenant, entre autres, le protocole de recherche ainsi que des informations relatives à la fabrication et à la sécurité du traitement doivent être soumis à Santé Canada avant le démarrage de l’essai clinique.
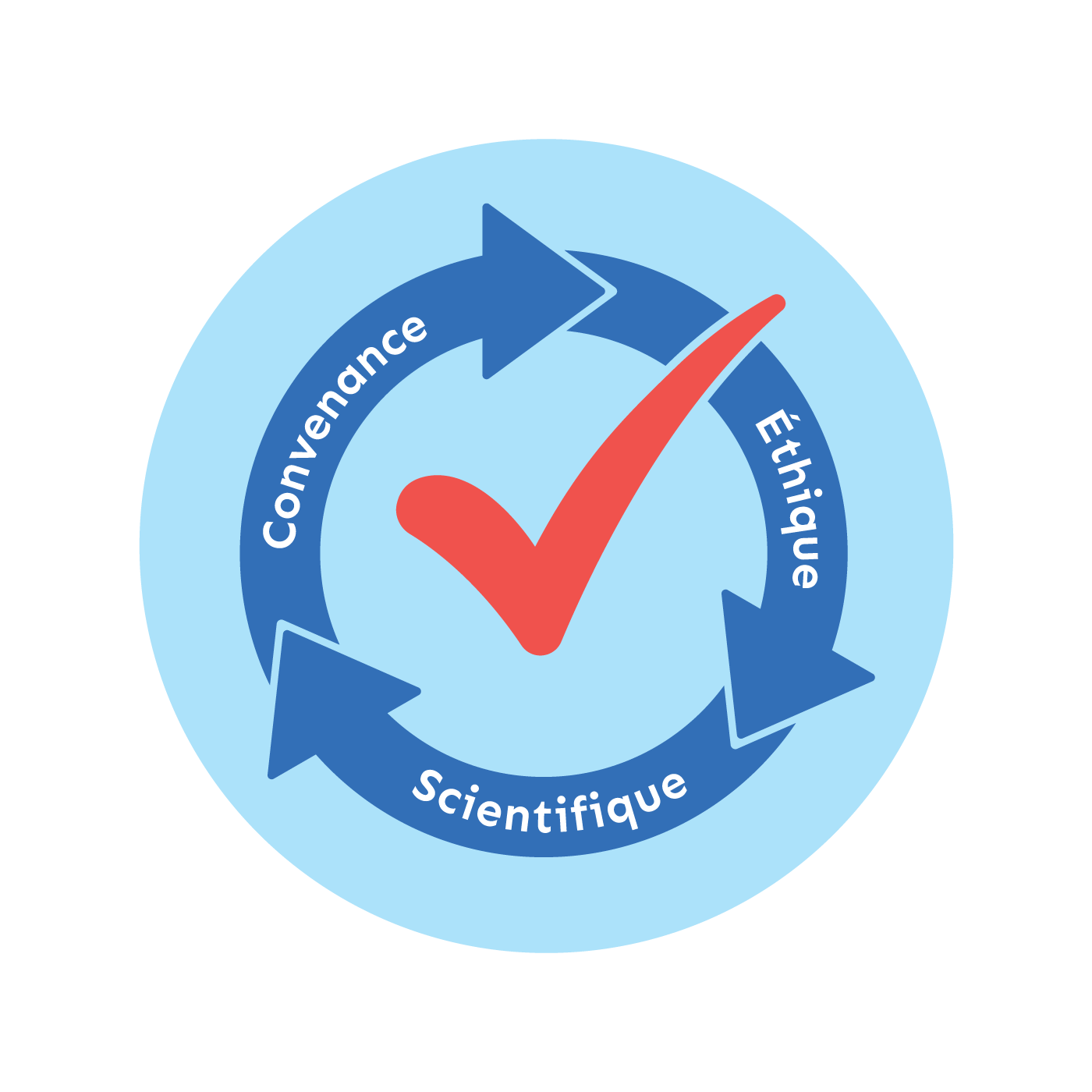
Avant d’être autorisé, chaque essai clinique fait aussi l’objet d’une triple évaluation : éthique, scientifique, et de la convenance.
L'évaluation scientifique est menée par des spécialistes du même domaine de recherche qui examinent la validité scientifique de l’essai clinique.
L’évaluation éthique est menée par un comité d’éthique de recherche (CER) qui examine l’ensemble des documents pertinents de l’essai clinique, plus particulièrement ceux qui seront présentés aux personnes participantes.
Le CER s’assure que l'essai clinique respecte les trois principes directeurs de l’Éthique de la recherche avec des êtres humains :
L’évaluation de la convenance est menée par l’établissement de santé où sera réalisé l’essai clinique. L’objectif est d’analyser la disponibilité des ressources matérielles et humaines nécessaires à la conduite de l’essai clinique dans l’établissement, ainsi que les considérations propres à chaque projet (priorités, pertinence...).

Une fois autorisé, l'essai clinique est mis en place dans un ou plusieurs établissements (ou sites), et le recrutement des personnes participantes est amorcé, en conformité avec le protocole de recherche autorisé.
En cours d’étude, l’essai est examiné en continu par différents types de comités, par exemple un Comité indépendant de contrôle des données (CICD), ces comités sont responsables d’évaluer périodiquement le déroulement, les données et les résultats de l’essai afin d'assurer la sécurité des personnes participantes. Si des effets indésirables apparaissent en cours de projet, ils sont rapportés à différentes instances (CER, Santé Canada...) afin de prendre une décision éclairée quant à la nécessité de suspendre ou d’arrêter l’étude.

À la fin de l’essai clinique, les données anonymes recueillies tout au long de l’essai sont analysées par le promoteur. Cette étape permet de décider :
Les conclusions de l’essai clinique sont aussi rapportées sous forme d’article scientifique dans une revue médicale spécialisée. Avant d’être publié, l’article est analysé par d’autres scientifiques du même domaine de recherche. Ces spécialistes évaluent la qualité de la démarche et la rigueur scientifique de l’essai clinique, avant d’autoriser ou non la publication.
Les résultats sont publiés tout en préservant l’anonymat des personnes qui ont participé à l’essai clinique.

Santé Canada, le comité d’éthique ou le promoteur peuvent mettre fin à un essai clinique à tout moment. Bien que très rare, une interruption peut survenir en raison de l’apparition d’effets secondaires plus graves que prévus, ou dans le cas où l’efficacité du traitement n’a pu être démontrée. Il arrive aussi que le nombre de personnes recrutées dans l’essai clinique soit insuffisant pour permettre la poursuite de l’étude.
Lorsqu’un essai clinique est interrompu, l’équipe de recherche informe les personnes participantes le plus tôt possible et les renseigne sur les étapes à venir.

Si les résultats des essais cliniques démontrent que le traitement à l’étude est efficace et sécuritaire, le manufacturier peut demander une autorisation de mise en marché à Santé Canada afin que ce nouveau traitement soit autorisé au pays. Dans le cadre de cette demande, Santé Canada évalue, entre autres, les résultats des essais précliniques et des essais cliniques réalisés, ainsi que les détails liés à la production, l’emballage et l’étiquetage du traitement.
Si l’ensemble des informations est jugé satisfaisant, Santé Canada émet un Avis de conformité et une Identification numérique de drogue (DIN), autorisant la prescription du traitement au Canada. Dans le cas où l’instance conclut qu’il y a insuffisance de preuve quant à la sécurité ou à l’efficacité du traitement, une autorisation de mise en marché ne sera pas accordée et le traitement ne sera pas autorisé au Canada.
Le processus d’autorisation canadienne dure généralement de 6 mois à 2 ans.

L’Institut national d’excellence en santé et en services sociaux (INESSS) a pour mandat de notamment évaluer des demandes d'inscription de médicaments, de produits sanguins et de dispositifs médicaux, dans le but de faire des recommandations au (à la) ministre de la Santé. Le (la) ministre de la Santé prend une décision en fonction des recommandations émises et la Régie de l’assurance maladie du Québec (RAMQ) opérationnalise le remboursement.
L’INESSS réalise son mandat d’évaluation des médicaments sur la base des cinq aspects prévus à l’article 7 de sa loi constitutive. L’INESSS procède à l’évaluation globale de la valeur du traitement, notamment les avantages cliniques (valeur thérapeutique), et du bienfait économique (valeur pharmacoéconomique) pour s’assurer de l’utilisation optimale des ressources dans le secteur de la santé et des services sociaux. Les informations se basent en partie sur les résultats des essais cliniques soumis par le manufacturier.
Toute personne ou tout groupe intéressés (incluant les spécialistes cliniques, les associations de patients et patientes et la population) peuvent soumettre leurs commentaires et avis sur un médicament visé par une évaluation de l'INESSS.
Suite à cette évaluation, l’INESSS recommande ou non au (ou à la) ministre de la Santé l’inscription du produit ou dispositif de santé au régime public d’assurance médicament pour une indication thérapeutique donnée.
S’ensuit, dans la plupart des cas, un processus de négociations pancanadiennes sur le prix, et le (ou la) ministre de la Santé inscrit, le cas échéant, le produit ou dispositif de santé au régime public d’assurance médicament. L’INESSS fixe les indications de paiement (aussi appelées critères de remboursement) qui seront gérées par la RAMQ ou par les établissements de santé.
Chaque année, plus d’une centaine de médicaments prometteurs sont évalués par l’INESSS. La liste des médicaments en cours d’évaluation est disponible sur le site Web de l’Institut.

L’Agence des médicaments et des technologies de la santé au Canada (ACMTS), l’Institut national d’excellence en santé et en services sociaux (INESSS) et Santé Canada collaborent pour fournir un accès rapide aux médicaments et aux dispositifs médicaux. Dans le cadre du processus d’examen aligné qui prévaut pour les médicaments, les trois organismes peuvent évaluer quasi en simultané les soumissions des fabricants lorsque ces derniers ont donné les autorisations pour le faire.
Ce processus permet de réduire le délai entre l’Avis de conformité de Santé Canada et la formulation des recommandations de l’INESSS. Le processus d’examen aligné ne change pas les exigences, la prise de décisions ou les processus respectifs tenus par Santé Canada et l’INESSS. Vous pouvez consulter ce site pour en savoir plus sur le processus d’examen aligné.

Une fois que le (ou la) ministre de la Santé autorise l’inscription d’un traitement au régime public, la Régie de l’assurance maladie du Québec (RAMQ) prend en charge l’accessibilité et les frais (en tout ou en partie) du traitement pour la population.
Si le (ou la) ministre de la Santé refuse l’inscription, le traitement ne sera pas inscrit au régime public et il ne sera pas couvert par la RAMQ.

Le Programme d'accès spécial (PAS) de Santé Canada permet au personnel médical de demander l’accès à des médicaments ou à des instruments médicaux qui ne sont pas encore autorisés au Canada. Ce programme vise des situations humanitaires ou urgentes, par exemple, des cas de personnes touchées par des conditions médicales graves ou encore des situations où les traitements standards ne sont pas disponibles.
Dans le cadre du PAS, le manufacturier prend généralement en charge le coût du médicament ou de l’instrument médical pour l’offrir aux personnes impliquées par la demande d’accès spécial.
En savoir plus
L’inscription d’un produit ou dispositif de santé en tant que « Médicament d'exception » permet à la population d’obtenir le remboursement de certains médicaments, habituellement non-remboursés, sous certaines conditions et si ces derniers sont utilisés dans le respect des indications reconnues pour leur paiement par l’INESSS.
Par exemple, une crème contre le psoriasis, habituellement non-remboursable, peut être remboursée en tant que médicament d'exception dans le cas où l’utilisation d’un autre traitement (tel que déterminé par l’INESSS) s’avère insuffisante pour les personnes souffrant de cette condition médicale.
La mesure du « Patient d'exception » permet de couvrir les frais, pour un patient ou une patiente, et de manière exceptionnelle, de médicaments non-inscrits à la liste des médicaments autorisés, ou bien de couvrir des médicaments d’exception prescrits pour une autre indication thérapeutique que celle prévue par l’INESSS dans sa liste.
Pour ces deux types d'accès, il est nécessaire qu'un spécialiste médical effectue préalablement une demande d’autorisation.
En savoir plus